في القرن الواحد والعشرين، تمرُّ الحياة سريعة، فالثورات العلميّة والصناعية في القرون السابقة هي ما جعلت الحياة أسهل بكثير من ذي قبل، وكل حدث في التاريخ نرى نتائجه في الحاضر، فلننظر إلى تاريخ الكيمياء، ونقتبس منه أكثر اللحظات الهامَّة حتى الآن. سنعرض في هذا المقال بعض التفاعلات الكيميائية الأكثر تأثيرًا في التاريخ، وسوف نبدأ جولتنا مع وجبة إفطار لذيذة، ونستكشف معًا كيف وضعت الكيمياء أثرًا في هذه الوجبة؟ ثم نذهب إلى معرفة أهمية عملية التخمُّر في الصناعة، ثم جولة مع صناعة الصابون، واستخلاص السيليكون، مرورًا بالتفاعل الكيميائي الذي كان له الأثر الكبير في إطعام البشرية ثم ننهي جولتنا بالاكتشافات الهائلة وراء تحطيم نظرية القوة الحيوية.
تفاعل ميلارد
منذ أن اخترع الإنسان الوجبات بعدما اكتشف النار، وجد أن الطعام الشهي أصبح يتميز بنكهته الرائعة ولونه المميز.
ولكن ما مفتاح هذه النكهات؟
ولماذا يرتبط اللّون البني بنضج الأكل؟ وما علاقته بالكيمياء؟

يُعتبر تفاعل ميلارد من التفاعلات الهامَّة المسؤولة عن التغيرات التي تحدث في الطعام من نكهات مميزة ولون بني كالقهوة المحمصة، والشوكولاتة، والخبز المحمص، وشريحة اللحم المشوية وغيرها من الأطعمة الأخرى. سُمِّيَ هذا التفاعل نسبة إلى الطبيب الفرنسي لويس كاميل ميلارد الذي اكتشفه لأول مرة عام 1910م.
تحدث تفاعلات ميلارد عندما تتفاعل الأحماض الأمينية مع السكريات المختزلة، التي تحتوي على مجموعة ألدهيد أو كيتون حرة. وبالتالي يمكن أن تتفاعل بسهولة مع الأحماض الأمينية والعديد من المركبات الأخرى.
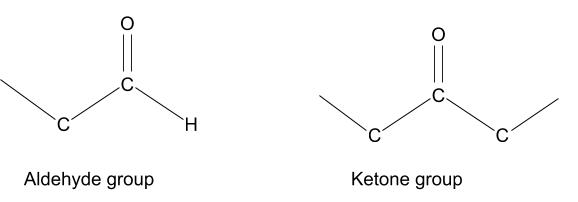
الأحماض الأمينية هي الوحدات الأساسية للبروتينات، لديهم عدة تركيبات مختلفة، ولكن جميعها تحتوي على مجموعة الأمين (NH2) في نهاية واحدة، ومجموعة الكاربوكسيل في النهاية الأخرى للحمض الأميني. مجموعة الأمين هي الجزء المشارك في هذه التفاعلات. يمكن أن تمتد سلسلة الكربون إلى أكثر من 500 وحدة مما يساهم في تعقيد هذه التفاعلات.(1)
ماذا يحدث أثناء التفاعل؟
- تتفاعل السكريات المختزلة مثل الجلوكوز أو الفركتوز مع الحمض الأميني.
- تتشكّل مركبات وسيطة غير مستقرة تُسمَّى مركبات Amadori التي تكون في البداية عديمة النكهة وعديمة اللون.
- تُنتَج مركبات جديدة ذات نكهة تسمى dicarbonyls.
- تستمر المئات من المنتجات الثانوية المختلفة في التكوين وتؤثِّر بدورها على النكهة والرائحة واللون.
- تتشكل جزيئات الصبغ (Melanoidin) ويظهر لون بني عميق على سطح الأطعمة.
من العوامل التي تؤثر على هذا التفاعل؛ درجة الحرارة، ومحتوى المياه، ونوع الوسط، فعند إضافة الوسط القاعدي إلى الطعام مثل بيكربونات الصوديوم فإنها تزيد من درجة الاحمرار وتساعد على سرعة الطهي.
تحتوي معظم الأطعمة بشكل طبيعي على كميَّات وأنواع مختلفة من البروتينات والسكر، وهذا هو السبب في أن لحوم البقر أو الدجاج يبدو طعمه ودرجة احمراره مختلفة عن خبز الموز عند طهيه. وتؤثر في هذه العملية طرق الحرارة العالية مثل التحميص، والقلي، والشوي، والطبخ بالضغط، والحرق.(2)
التخمر
التخمٌّر هو عملية التمثيل الغذائي «الأيض»، تحدث في الكائن الحي لتحويل الكربوهيدرات مثل: النشا أو السكر، إلى الكحول أو الحامض. على سبيل المثال: تُحَوِّل الخميرة السكر إلى كحول للحصول على الطاقة فيما يُعرَف بالتخمُّر.
مصطلح «التخمُّر» يأتي من الكلمة اللاتينية (fervere) وتعني «يغلي»، وُصِفَ التخمير من قبل الخيميائيين في أواخر القرن الرابع عشر، ولكن ليس بالمعنى الحديث. وفي عام 1600م أصبحت العملية الكيميائية للتخمير موضوعاً للبحث العلمي.
التخمير هو عملية طبيعية، طبَّقها الناس لصنع منتجات مثل: النبيذ، والجبن، والبيرة قبل وقت طويل من فهم العملية البيوكيميائية التي تحدث. في عام 1850م و1860م، أصبح لويس باستور أول عالم لدراسة التخمير عندما وضَّح أن سببه هو الخلايا الحية، ومع ذلك لم ينجح باستور في محاولاته لاستخراج الإنزيم المسؤول عن التخمير من خلايا الخميرة. في عام 1897م، استخرج الكيميائي الألماني إدوارد بوخنر السوائل من خميرة الأرض، ووجد أن هذا السائل يمكن أن يخمِّر محلول السكر، وتُعتَبر تجربة بوشنر هي بداية علم الكيمياء الحيوية، التي بها حصل على جائزة نوبل في الكيمياء لعام 1907م.
معظم الناس على علم بالمواد الغذائية والمشروبات التي هي منتجات لعملية التخمير، ولكن قد لا يدركون العديد من المنتجات الصناعية الهامَّة الأخرى التي تُنتَج أيضًا من عملية التخمير ومنها: البيرة، والنبيذ، والزبادي، والجبن، وبعض الأطعمة الحامضة التي تحتوي على حمض اللاكتيك بما في ذلك مخلل الملفوف، وخميرة الخبز، ومعالجة مياه الصرف الصحي، والوقود الحيوي، وغاز الهيدروجين.
- عملية التخمُّر لإنتاج الكحول الإيثيلي أو الإيثانول
يُنتَج الإيثانول من تخمير سكر الجلوكوز
C6H12O6 (glucose) → 2 C2H5OH (ethanol) + 2 CO2 (carbon dioxide)
- عملية التخمُّر لإنتاج حمض اللاكتيك
يُستخدَم تخمير حمض اللاكتيك في إنتاج الزبادي حيث يتحول اللاكتوز إلى حمض اللاكتيك. كما يحدث في عضلات الحيوان عندما يحتاج الجسم إلی الطاقة بمعدل أكبر من الذي يوفره الأكسجين.
يُنتَج حمض اللاكتيك من الجلوكوز كما توضح هذه المعادلة:
C6H12O6 (glucose) → 2 CH3CHOHCOOH (lactic acid)
كما يمكن إنتاج حمض اللاكتيك من اللاكتوز والماء:
C12H22O11 (lactose) + H2O (water) → 4 CH3CHOHCOOH (lactic acid)
- يمكن إنتاج غاز الهيدروجين والميثان بواسطة التخمُّر
التخمير هو عملية لاهوائية، وهذا يعني أنها لا تتطلب الأكسجين لكي تحدث، ومع ذلك حتى عندما يكون الأكسجين وفيرًا، تُفضِّل خلايا الخميرة التخمير على التنفس الهوائيِّ، بشرط توفُّر كمية كافية من السكر.
- يحدث التخمٌّر في الجهاز الهضمي للبشر والحيوانات الأخرى
هناك حالة طبية نادرة تسمّى متلازمة تخمر الأمعاء، يؤدي التخمُّر في الجهاز الهضمي البشري إلى التسمم بسبب إنتاج الإيثانول. كما يحدث التخمر أيضًا في خلايا العضلات البشرية حيث يُستَهلَك الأدينوسين ثلاثي الفوسفات (ATP) بكميات أسرع مما يمكن للأكسجين توفيره، وفي هذه الحالة يُنتَج عن تحلل السكر جزيئات ATP التي بدورها لا تَستخدِم الأكسجين.
على الرغم من أن التخمير هو طريقة شائعة، إلا أنه ليس الطريقة الوحيدة التي تستخدمها الكائنات الحية للحصول على الطاقة اللاهوائية. تَستَخدِم بعض الأنظمة الكبريتات كمستقبل الإلكترون النهائي في سلسلة نقل الإلكترون في عملية التنفس.(3)
عملية التصبن

الصابون له ماضٍ غامض. لا أحد يعرف على وجه اليقين متى اختُرِع الصابون لأول مرة، على الرغم من احتمال وجوده منذ فجر الحضارة. أحد الأسباب التي تجعل من الصعب جدًّا التنبؤ بأول ظهور للصابون هو أن من الممكن صنعه باستخدام عدد قليل من المكونات البسيطة؛ في الواقع يمكن فقط للقلويات الممزوجة بالدهون أو الزيت صنع الصابون.
قبل القرن الثامن عشر، لم ينتشر استخدام الصابون على نطاق واسع، ليس فقط لأنه مُكلِّف للغاية بالنسبة للجميع، ولكن كان له رائحة كريهة أيضًا. لحسن الحظ مع الثورة الصناعية جاءت طرق جديدة لإنتاج الصابون، ومع استيراد المكونات الغريبة والعطرة من أفريقيا وآسيا، مثل زيوت النخيل، وجوز الهند، أصبح الصابون أكثر جاذبية.(4)
الصابون هو منتج للتنظيف مصنوع من مكونات طبيعية. التَصبُّن هو اسم التفاعل الكيميائي الذي يُنتِج الصابون. في هذه العملية، تتحول الدهون الحيوانية أو النباتية إلى صابون «حمض دهني». يتطلب التفاعل محلول قلوي على سبيل المثال محلول هيدروكسيد الصوديوم، أو هيدروكسيد البوتاسيوم، وأيضًا الحرارة.
الدهون الثلاثية + هيدروكسيد الصوديوم أو هيدروكسيد البوتاسيوم ← الجلسرين + 3 جزيئات صابون
يُستخدَم التفاعل تجاريًّا لصنع الصابون، ومواد التشحيم، وطفايات الحريق.(5)
السيليكون
السيليكون (Si) عنصر كيميائي يُصنَّف على أنه شبه فلز. في عام 1824م، حصل عليه العالم السويدي جاكوب برزليوس عن طريق تفاعل فلوروسيليكات البوتاسيوم مع البوتاسيوم، وتنقية المنتج مع الغسيل المتكرر، وقد سمَّى العنصر الجديد (Silicium). وفي عام 1831م، أعاد الكيميائي الإسكتلندي توماس طومسون تسميته بالسيليكون (Silicon).

كان الكوارتز «ثاني أكسيد السيليكون المتبلور» معروفًا للناس لعدة آلاف من السنين. الصوان هو شكل من أشكال الكوارتز، وكانت معظم الأدوات المستخدمة يوميًّا في العصر الحجري القديم من حجر الصوان.
يعتبر السيليكون هو ثاني أكثر العناصر وفرة في القشرة الأرضية بعد الأكسجين والثامن في الكون. يشكل عنصرا السيليكون (27.7٪) والأكسجين (47.3٪) معاً ما يقرب من ثلاثة أرباع وزن القشرة الأرضية. معظم السيليكون على كوكب الأرض متواجد في صورة ثاني أكسيد السيليكون (SiO2) المعروف بالرمل أو الكوارتز.(6)
استخدامات السيليكون
- عنصر رئيسي في صناعة السيراميك والطوب والزجاج.
- كونه من أشباه موصلات؛ فيمكن استخدامه لصنع الترانزستورات.
- يستخدم على نطاق واسع في رقائق الكمبيوتر والخلايا الشمسية.
- مكوِّن أساسي في الأسمنت البورتلاندي.
- يستخدم في إنتاج الطوب الناري.
- يستخدم كمكوِّن في العديد من أنظمة العزل المائي.
- يُكوِّن الحديد والسليكون معاً سبيكة تُستخدَم على نطاق واسع في صناعة الصلب.(7)
عملية هابر-بوش
في بداية القرن العشرين الميلادي كان عدد سكان العالم في ازدياد، وزاد متوسط عمر الفرد المتوقع بفضل التقدم الطبي والتطورات التكنولوجية. ونتيجة لذلك، لم تتمكن الإمدادات الغذائية في العالم من مواكبة وتيرة الزيادة السكانية، وبدأ العلماء في البحث عن طرق لزيادة إنتاجية التربة.
بمجرد أن اكتشف العلماء أن قلة النيتروجين المغذّي تحدُّ من نمو النبات، بدأ المزارعون في نشر السماد والنفايات الحيوانية على تربتهم لإضافة النترات إليها، كما زرعوا الأنواع التي تساعد طبيعيًّا على تثبيت النيتروجين في التربة مثل فول الصويا، والفول السوداني. ومع ذلك لم توفر هذه الطريقة النترات الأساسية لزيادة نمو النبات، وتلبية الطلب على الغذاء.
في عام 1909م، اكتشف فريتز هابر أنه يستطيع بنجاح معالجة النيتروجين في الهواء الجوي وتحويله إلى أمونيا. بعد بضع سنوات، باستخدام نتائج العالِم هابر، طوَّر العالِم كارل بوش أول تطبيق على نطاق صناعي لعملية هابر-بوش وبدأ إنتاج الأسمدة النيتروجينية على نطاق واسع لتعزيز نمو المحاصيل، وإطعام العالم. اليوم تعدُّ عملية هابر-بوش جزءًا رئيسيًّا من العملية التقليدية لزراعة المحاصيل في جميع أنحاء العالم.
تفاعل هابر-بوش(8):
N2 + 3 H2 → 2 NH3
كيف يمكن الحصول على الهيدروجين بعملية هابر-بوش؟
يمكن الحصول على الهيدروجين عادةً عن طريق التحلُّل المائي، الذي يتكون من تيار كهربائي يمر عبر الماء ويفصل الأكسجين عن الهيدروجين. وحاليًا، تُعَدُّ معالجة غاز الميثان البخاري، حيث يُخلَط الميثان بالبخار المُسخَّن، الطريقة الأكثر شيوعًا بسبب كفاءتها العالية، وتكلفتها الأقل؛ فيُنتَج الهيدروجين عادةً عن طريق الميثان، وهو غاز أقوى 84 مرة من ثاني أكسيد الكربون.
كيف يمكن الحصول على النيتروجين بعملية هابر-بوش؟
وذلك عن طريق التقطير التجزيئي للهواء المُسال «عن طريق تبريده إلى أقل من -200 درجة سيليزية» حيث يتبخر الأكسجين والكربون، ثم يُجمَع النيتروجين.(9)
تحطيم نظرية القوة الحيوية
ما الذي يجعلك مختلفًا عن الصخرة؟…. ما الذي يميز الحياة؟…. ما الذي يميز الكيمياء العضوية عن الكيمياء غير العضوية؟…. في القرن الثامن عشر والتاسع عشر، كان يُعتقد أنه لا يمكن الحصول على المركبات العضوية إلا من الكائنات الحية. وكان ذلك بسبب نظرية القوة الحيوية بأن جميع الكائنات الحية قد أدَّت إلى تشكيل المركبات العضوية، لذلك كان هناك تمييز بين المركبات العضوية والمركبات غير العضوية، حيث أن كلمة عضوي تعني أنه مشتق من كائن حي، بينما غير العضوي هو كل شيء آخر. نعلم اليوم أن هذا التمييز غير صحيح، ومع ذلك نواصل التمييز بين الكيمياء العضوية، والكيمياء غير العضوية نظرًا لأهمية المركبات العضوية في العالم.
في عام 1828م أثبت فريدريك فولر أن نظرية القوة الحيوية خاطئة عن طريق إنتاج اليوريا صناعيًّا.
في أوائل القرن الثامن عشر، تعلَّم العلماء بالفعل كيفية عزل العديد من المركبات العضوية من النباتات. ومع ذلك، اعتقدوا أن القوة الحيوية في النباتات هي الطريقة الوحيدة لإنتاج هذه المركبات. في عام 1828م، كان فريدريك فولر أول عالِم ينتج صناعيًّا أحد هذه المركبات: وهو اليوريا عن طريق تفاعُل سيانات الفضة مع كلوريد الأمونيوم. جعل هذا الاكتشاف العلماء يدركون أن هذه المركبات العضوية يمكن تصنيعها بالفعل وأنه لا توجد قوة حيوية.(10)
تفاعُل فريدريك فولر:
AgNCO + NH4Cl ⟶ (H2N)2CO + AgCl
من هنا تنطلق ملايين المركبات العضوية التي ملأت العالم في كل مكان حولنا. فهي أساسية للنمو الاقتصادي للدول حيث تدخُل في العمليات الصناعية كالمطاط، والبلاستيك، والوقود، والأدوية، ومستحضرات التجميل، والمنظفات، والطلاء، والصبغات، وكذلك في الصناعات الزراعية. تستند أسس الكيمياء الحيوية، والتكنولوجيا الحيوية، والطب على المركبات العضوية ودورها في العمليات الحيوية، حيث تتكون العديد من المواد الحديثة ذات التقنية العالية جزئيًّا على الأقل من مركبات عضوية.(11)

