
لقد قررت جمعية نوبل في معهد كارولينسكا اليوم منح جائزة نوبل في الطب وعلم وظائف الأعضاء لعام 2018 إلى (جيمس بي أليسون) و(تاسكو هونجو) معًا، لاكتشافهما علاج للسرطان عن طريق تثبيط التنظيم السلبي للجهاز المناعي.
ملخص
يقتل السرطان ملايين البشر كل عام، لذا يشكل السرطان أحد أهم التحديات الصحية التي تواجه البشرية. بواسطة تحفيز القدرة المتأصلة لجهازنا المناعي على مهاجمة الخلايا السرطانية أسس حاملو جائزة نوبل هذا العام مبدأ جديدًا تمامًا لعلاج السرطان.
درس العالم (جيمس بي أليسون) بروتينًا معروفًا يعمل كفرامل تكبح جهاز المناعة، وأدرك إمكانية إيقاف هذه الفرامل، وبالتالي إطلاق خلايا المناعة لدينا لمهاجمة الأورام. ثم طوّر هذا المفهوم إلى منهجٍ جديد تمامًا لعلاج المرضى.
بشكل موازٍ، اكتشف العالم (تاسكو هونجو) بروتينًا في الخلايا المناعية، وبعد استكشاف دقيق لوظائفه، كشف في النهاية أنّه يعمل أيضًا كفرامل للجهاز المناعيّ، ولكن بآلية عمل مختلفة. ثَبُت أن العلاجات القائمة على اكتشافه فعالة بشكلٍ لافت للنظر في مكافحة السرطان.
وأظهر كل من (أليسون) و(هونجو) كيف يمكن استخدام استراتيجيّات مختلفة لتثبيط المكابح على الجهاز المناعيّ في علاج السرطان. وتشكل الاكتشافات التي حققها الحائزان على الجائزة أحد المعالم البارزة في كفاحنا ضد السرطان.
هل يمكن لجهاز المناعي أن يشارك في الدفاع عنا ضد السرطان؟
يشمل السرطان العديد من الأمراض المختلفة، جميعها يتميّز بالتوالد غير المنضبط للخلايا غير الطبيعية مع القدرة على الانتشار إلى الأعضاء والأنسجة السليمة.
هناك العديد من الأساليب العلاجية المتاحة لعلاج السرطان، بما في ذلك الجراحة، والإشعاع، واستراتيجيّات أخرى، بعضها مُنِح جوائز نوبل سابقة. وتشمل هذه الأساليب، العلاج الهرموني لسرطان البروستاتا (Huggins, 1966)، والعلاج الكيميائي (Elion and Hitchins، 1988)، وزراعة نخاع العظام لسرطان الدم (Thomas, 1990). ومع ذلك، يبقى علاج السرطان المتقدم شديد الصعوبة، وبالتالي، هناك حاجة ماسة لاستراتيجيات علاجية جديدة.
في أواخر القرن التاسع عشر وبدايات القرن العشرين، ظهر مبدأ يقول أنّ تفعيل الجهاز المناعيّ قد يكون استراتيجيّة فعّالة لمهاجمة الخلايا السرطانية.
أجريت محاولات لإصابة المرضى ببكتيريا لتفعيل الدفاع المناعي. وكان تأثير هذه الجهود متواضعًا. ولكن يتم استخدام هذه الاستراتيجية بشكلٍ مختلف اليوم في علاج سرطان المثانة. لقد أُدِرك وقتها أن هناك حاجة لمزيد من المعرفة. شارك العديد من العلماء في أبحاث أساسية مكثفة وأبحاث عن آليات عمل جوهرية غير مُكتَشَفَة تنظم المناعة، كما أظهروا أيضًا كيف يستطيع جهاز المناعة التعرف على خلايا السرطان. وعلى الرغم من التقدم العلمي الملحوظ، إلا أن محاولات تطوير استراتيجيات جديدة لمكافحة السرطان ثَبُتَ أنها صعبة.
المسرعات والمكابح في جهازنا المناعي
إن الخاصية الأساسية لجهازنا المناعي هي قدرته على تمييز بين ما هو “ذاتي” -أي من أصل خلايانا- وما هو “غير ذاتي” -أي غريب أو مختلف عن خلايانا الأصلية-، بحيث يمكنه مهاجمة البكتيريا والفيروسات وغيرها من المخاطر الي تغزو أجسامنا والقضاء عليها.
تعتبر الخلايا التائية (T cells)، وهي نوعٌ من خلايا الدم البيضاء، لاعبًا أساسيًا في دفاع الجهاز المناعي. حيث تبين أنَّ الخلايا التائية لها مستقبلات ترتبط بالهياكل التي يتم التعرف على كونها “غير ذاتية”، وهذه التفاعلات تثير جهاز المناعة للمشاركة في الدفاع. ولكن لإطلاق استجابة مناعية كاملة، هناك احتياج لبروتينات إضافية أيضًا تعمل كمسرّعات للخلايا التائية (انظر للشكل). ساهم العديد من العلماء في هذا البحث الأساسي الهام، وتعرفوا على بروتينات أخرى تعمل كمكابح للخلايا التائيّة، مما يثبط التنشيط المناعي. هذا التوازن المعقّد بين المعجّلات والفرامل ضروري للتحكم الصارم. وهو يضمن أن نظام المناعة يعمل بشكل كاف في الهجوم ضد الكائنات الدقيقة الأجنبية، مع تجنب التنشيط المفرط الذي يمكن أن يؤدّي إلى تدمير الخلايا والأنسجة السليمة بواسطة المناعة الذاتية.
مبدأ جديد للعلاج المناعي
خلال التسعينات، في مختبره في جامعة كاليفورنيا، بيركلي، درس (جيمس بي أليسون) بروتين الخلايا التائية (CTLA-4). وكان واحدًا من العديد من العلماء الذين قاموا بملاحظة أن البروتين (CTLA-4) يعمل بمثابة مكابح للخلايا التائية. استغلَّت فرق بحث أخرى الآلية في علاج أمراض المناعة الذاتية. على الرغم من ذلك، كان لدى أليسون فكرة مختلفة تمامًا. لقد كان قد طوّر بالفعل جسمًا مضادًا يمكنه الارتباط بالبروتين (CTLA-4) وحجب وظيفته (انظر للشكل). ثم بدأ بالتحقّق مما إذا كان حصار (CTLA-4) يمكن أن يحرّر من فرملة الخلايا التائية ويطلق العنان لجهاز المناعة لمهاجمة الخلايا السرطانية. أجرى أليسون وزملاؤه تجربة أولية في نهاية عام 1994، وكُرّرت تجربتهم على الفور خلال عطلة عطلة عيد الميلاد. كانت النتائج مذهلة. لقد عولجت الفئران المصابة بالسرطان بواسطة علاج بالأجسام المضادة التي تثبط المكابح المناعيّة، وتطلق نشاط الخلايا التائية المضادة للورم. وعلى الرغم من الاهتمام الضئيل من صُناع الأدوية، إلّا أن أليسون واصل جهوده المكثفة لتطوير الاستراتيجية في علاج للبشر. وسرعان ما ظهرت نتائج واعدة من عدة مجموعات، وفي عام 2010، أظهرت دراسة سريرية مهمة آثارًا مذهلة في المرضى المصابين بالورم الميلانيني المتقدم، وهو نوع من سرطان الجلد. في عدة مرضى اختفت علامات السرطان المتبقي. مثل هذه النتائج الرائعة لم يسبق رؤيتها من قبل في هذه المجموعة من المرضى.
آلية عمل العلاج
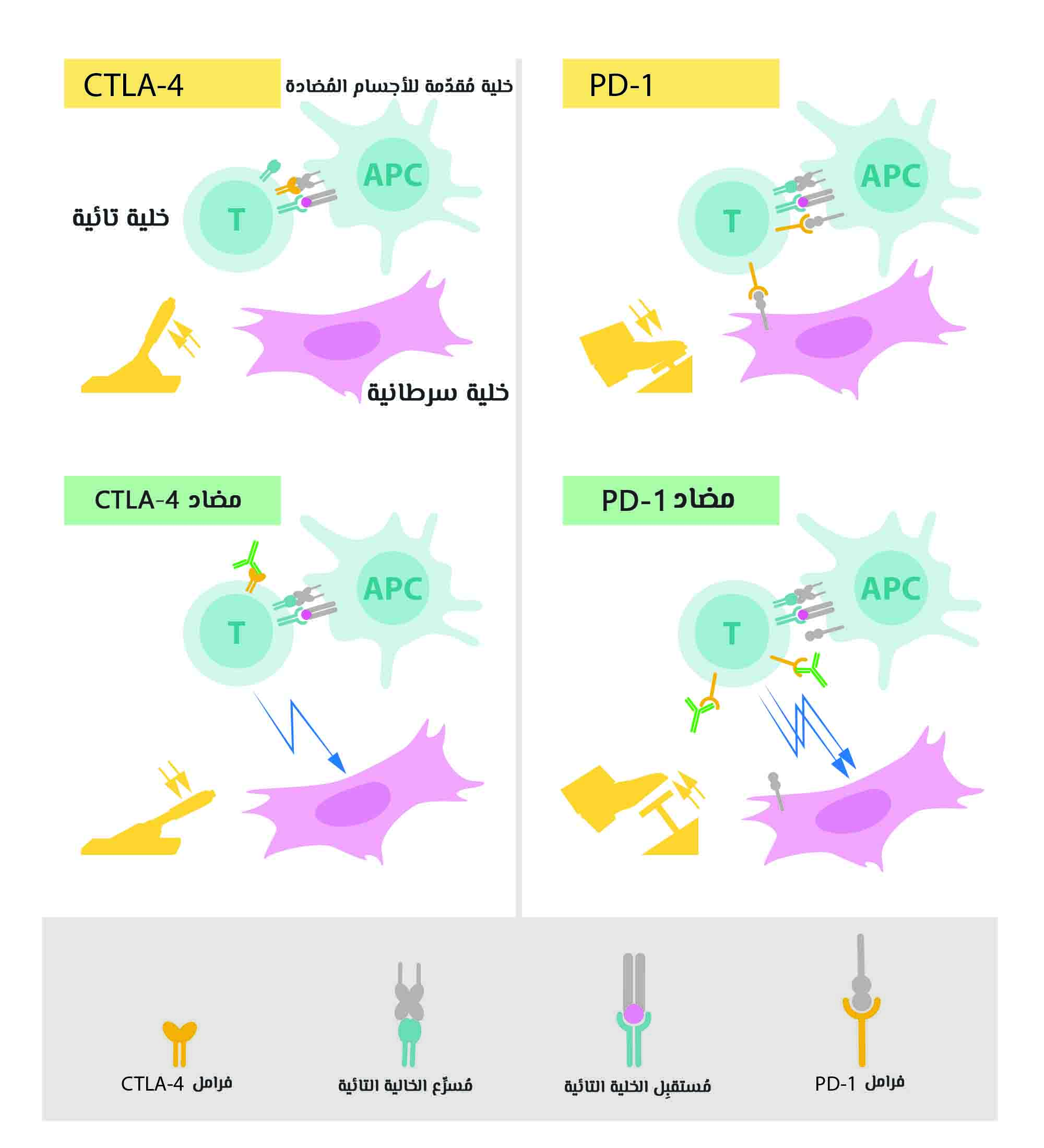
أعلى اليسار: تنشيط الخلايا التائية والذي يتطلب أن يرتبط مستقبل الخلايا التائية بهياكل على خلايا مناعية أخرى تم التعرف على بكونها “غير ذاتية”. ويوجد أيضًا بروتين يعمل بمثابة مسرّع تنشيط الخلية التائية. أما (CTLA-4) فيعمل كمكبح على الخلايا التائية لتثبيط وظيفة المسرع.
أسفل اليسار: الأجسام المضادة (خضراء اللون) ضد بروتين (CTLA-4) تحجب وظيفة المكبح مما يؤدّي إلى تنشيط الخلايا التائية والهجوم على الخلايا السرطانية.
أعلى اليمين: يوجد بروتين (PD-1)، وهو مكبح آخر للخلايا التائية مما يمنع تنشيطها.
أسفل اليمين: الأجسام المضادة لـ (PD-1) تثبط وظيفة المكبح مما يؤدّي إلى تنشيط الخلايا التائية والهجوم على الخلايا السرطانية بكفاءة عالية.
اكتشاف PD-1 وأهميته لعلاج السرطان
في عام 1992، قبل بضع سنوات من اكتشاف أليسون، اكتشف تاسكو هونجو (PD-1)، وهو بروتين آخر يوجد على سطح الخلايا التائية. وعقد العزم على كشف دوره، واستكشف وظيفته بدقة من خلال سلسلة تجارب رائعة أجريت على مدار سنوات عديدة داخل مختبره في جامعة كيوتو. أظهرت النتائج أن (PD-1)، يشبه (CTL-4)؛ حيث يعمل كمكبح للخليّة التائيّة، ولكنه يعمل من خلال آلية مختلفة (انظر للشكل). في التجارب الحيوانيّة، أُظهِر حجب (PD-1) كاستراتيجية واعدة في حربنا ضد السرطان، كما أثبت هونجو وآخرون. مهد هذا الطريق لاستخدام (PD-1) كهدف في علاج المرضى. تبع ذلك تطوّر على الصعيد الإكلينيكي، وفي عام 2012، أظهرت دراسة مهمة فعاليّة واضحة في علاج المرضى الذين يعانون من أنواع مختلفة من السرطان. كانت النتائج مفاجئة، مما أدى إلي تسكين واحتمالية شفاء العديد من المرضى الذين يعانون من سرطان واسع الانتشار (metastatic cancer)، وهي حالة كانت تعتبر في السابق غير قابلة للعلاج من الأساس.
علاج «نقاط التفتيش المناعيَّة» للسرطان بين الحاضر والمستقبل
بعد الدراسات الأوليَّة التي تُظهِر آثار حصار بروتينات (CTLA-4) و (PD-1)، كان التطوّر السريريّ دراماتيكيًا. نحن الآن نعلم أنَّ العلاج، الذي يُشار إليه غالبًا باسم «الحاجز المناعي»، قد غيَّر النتائج العلاجيَّة بالنسبة لمجموعات معينة من المرضى المصابين بالسرطان المتقدم. ومثل غيره من العلاجات السرطانية، قد لوحظ وجود آثار جانبية ضارة للعلاج، والتي يمكن أن تكون خطيرة، وحتى تهدد الحياة. الآثار الجانبية ناجمة عن استجابة مناعية مفرطة النشاط تؤدّي إلى ردود فعل متعلّقة بالمناعة الذاتية، ولكن عادة ما تكون هذه الآثار الجانبية قابلة للسيطرة عليها. يركّز البحث المستمر والمكثف على توضيح آليات العمل، بهدف تحسين العلاجات والحد من الآثار الجانبية.
من بين الاستراتيجيتين العلاجيتين، ثبت أن علاج «نقاط التفتيش المناعيَّة» أكثر فاعلية مقارنة بعلاج «PD-1» ولوحظ أنَّ له نتائج إيجابية في علاج عدة أنواع من السرطان، بما في ذلك سرطان الرئة، والكلى، والغدد الليمفاوية والجلد. تشير الدراسات السريرية الجديدة إلى أن العلاج المركب، الذي يستهدف كل من البروتينات (CTLA-4) و (PD-1)، يمكن أن يكون أكثر فعاليّة، كما هو موضح في المرضى المصابين بالميلانوما (الورم الميلاني). وبذلك، ألهمت الجهود المبذولة العالمان (أليسون) و(هونجو) لدمج استراتيجيات مختلفة لإزالة مكابح الجهاز المناعيّ بهدف القضاء على خلايا الورم بشكلٍ أكثر كفاءة. وهناك عدد كبير من تجارب علاج «نقاط التفتيش المناعيَّة» تجري حاليًا ضد معظم أنواع السرطان، وتُختبَر في الحواجز المناعيّة بروتينات جديدة كأهداف.
حاول العلماء لأكثر من 100 عام إشراك جهاز المناعة في مكافحة السرطان. وقد كان التقّدم السريريّ في هذا المسار العلاجيّ متواضعًا حتى هذه الاكتشافات الحاسمة من قبل الحائزين على الجائزة. وقد أحدث علاج «نقاط التفتيش المناعيَّة» ثورة في علاج السرطان، وقد غيّر بشكلٍ أساسيّ الطريقة التي نتعامل بها مع كيفيّة التحكم في السرطان وعلاجه.
تعريف بالعلماء
جيمس بي أليسون
ولد جيمس بي أليسون (James P. Allison) عام 1948 في أليس، تكساس، الولايات المتحدة الأمريكية. حصل على درجة الدكتوراه عام 1973 في جامعة تكساس، أوستن. من 1974-1977 كان زميل ما بعد الدكتوراه في عيادة ومؤسسة أبحاث سكريبس، بمقاطعة لا جولا (La Jolla)، بكاليفورنيا. ومن 1977-1984 كان عضوًا في هيئة التدريس في مركز السرطان بجامعة تكساس، سميثفيل، تكساس. ومن 1985-2004 عضوًا في هيئة التدريس بجامعة كاليفورنيا، بيركلي، ومن 2004-2012 عضوًا في هيئة تدريس مركز ميموريال سلون كيترينج للسرطان، بنيويورك. ومن 1997-2012 كان محققًا في معهد هوارد هيوز الطبي. ومنذ عام 2012، عمل أستاذًا في مركز إم دي أندرسون للسرطان في جامعة تكساس، بهيوستن، وهو مرتبط بمعهد باركر للعلاج المناعيّ للسرطان (Cancer Immunotherapy).
تاسوكو هونجو
وُلِد تاسوكو هونجو (Tasuku Honjo) عام 1942 في كيوتو، اليابان. وفي عام 1966 حصل على بكالوريوس في الطب، ومن عام 1971 إلى عام 1974 كان زميل أبحاث في الولايات المتحدة الأمريكية بمعهد كارنيغي (Carnegie) في واشنطن، بالتيمور وفي المعاهد الوطنية للصحة، بيثيسدا، ميريلاند. حصل على درجة الدكتوراه عام 1975 في جامعة كيوتو. ومن 1974 إلى عام 1979 كان عضوًا في هيئة التدريس بجامعة طوكيو ومن عام 1979 إلى عام 1984 كان عضوًا في هيئة التدريب بجامعة أوساكا. ومنذ عام 1984 كان أستاذًا في جامعة كيوتو. وكان عميدًا لكليّة في جامعة كيوتو من عام 1996 إلى 2000 ومن عام 2002 إلى عام 2004.
للاستزادة
Ishida, Y., Agata, Y., Shibahara, K., & Honjo, T. (1992). Induced expression of PD-1, a novel member of the immunoglobulin gene superfamily, upon programmed cell death. EMBO J., 11(11), 3887–3895.
Leach, D. R., Krummel, M. F., & Allison, J. P. (1996). Enhancement of antitumor immunity by CTLA-4 blockade. Science, 271(5256), 1734–1736.
Kwon, E. D., Hurwitz, A. A., Foster, B. A., Madias, C., Feldhaus, A. L., Greenberg, N. M., Burg, M.B. & Allison, J.P. (1997). Manipulation of T cell costimulatory and inhibitory signals for immunotherapy of prostate cancer. Proc Natl Acad Sci USA, 94(15), 8099–8103.
Nishimura, H., Nose, M., Hiai, H., Minato, N., & Honjo, T. (1999). Development of Lupus-like Autoimmune Diseases by Disruption of the PD-1 gene encoding an ITIM motif-carrying immunoreceptor. Immunity, 11, 141–151.
Freeman, G.J., Long, A.J., Iwai, Y., Bourque, K., Chernova, T., Nishimura, H., Fitz, L.J., Malenkovich, N., Okazaki, T., Byrne, M.C., Horton, H.F., Fouser, L., Carter, L., Ling, V., Bowman, M.R., Carreno, B.M., Collins, M., Wood, C.R. & Honjo, T. (2000). Engagement of the PD-1 immunoinhibitory receptor by a novel B7 family member leads to negative regulation of lymphocyte activation. J Exp Med, 192(7), 1027–1034.
Hodi, F.S., Mihm, M.C., Soiffer, R.J., Haluska, F.G., Butler, M., Seiden, M.V., Davis, T., Henry-Spires, R., MacRae, S., Willman, A., Padera, R., Jaklitsch, M.T., Shankar, S., Chen, T.C., Korman, A., Allison, J.P. & Dranoff, G. (2003). Biologic activity of cytotoxic T lymphocyte-associated antigen 4 antibody blockade in previously vaccinated metastatic melanoma and ovarian carcinoma patients. Proc Natl Acad Sci USA, 100(8), 4712-4717.
Iwai, Y., Terawaki, S., & Honjo, T. (2005). PD-1 blockade inhibits hematogenous spread of poorly immunogenic tumor cells by enhanced recruitment of effector T cells. Int Immunol, 17(2), 133–144.
المصدر
المُشاركون في المقال
إعداد: زهراء منير
مراجعة: إسلام سامي
تصميم: محمد سيد الجوهري

